夏です。木々の緑が鮮やかな季節がやってきました。

[tsujimotterの母校、北大にて撮影]
植物の葉を眺めてると、私はいつもこんな疑問を思い浮かべます。
どうして緑色なのだろうか?
色は、私たちは幼い頃から知っている身近な存在です。その一方で、とても神秘的な存在でもあります。
考えれば考えるほど、その正体が分からなくなってしまうのです。
たとえば、みなさんは色の仕組みに関するこんな問いに答えられるでしょうか?
・絵具を混ぜて金色が作れないのはなぜだろう?(そもそも金色っていったい何なのだろう)
・モルフォチョウの翅の色がきらびやかな青色をしているのはなぜだろう?(自然界には青色をした物質はほとんどない)
今回考えたいのは「植物の葉はなぜ緑色なのか?」です。
この問いを突き詰めていくと、分子の中にある電子にまで到達します。そう、量子化学の話になるのです。色というマクロに見える現象を理解するために、ミクロな世界の法則が関係してくるのです。なんて壮大なスケールの話でしょう。
最初はみなさんが良く知っている簡単な事実からスタートします。そして、かなり深いところまで掘り下げていきたいと思います。
全体を通しては幅広いレンジの知識を持った方を対象とする記事となっています。みなさんが各々で満足いったところで途中で抜けていただいてもOKですし、最後まで付き合っていただけるのはそれはそれで嬉しいです。
それでは、本題に入っていきましょう! 深遠な色の世界にご招待!!
0. 目次と関連する記事
目次:
実は、先日まで書いていた「日曜化学シリーズ」の記事は、今回の内容を理解するために勉強してきたのでした。
tsujimotter.hatenablog.com
Pythonを使って分子の中の電子の分布を可視化できるようになり、ミクロな世界への理解がずいぶんと深まりました。
今回は日曜化学シリーズ最終回です。満を持して、色の謎に挑みたいと思います。
1. 植物の葉はなぜ緑色なのか?
「植物の葉はなぜ緑色なのか?」についての最もシンプルな回答は 「葉緑体が入っているから」 です。
葉緑体というのは、みなさんよくご存じの通り、植物が光合成をするために不可欠な物質です。これがたくさん葉の細胞の中に入っており、緑色をしているわけです。
実際、植物の細胞を撮った写真がこちらです。
これはPlagiomnium affineというコケ植物の拡大写真だそうなのですが、細胞(六角形の格子状の細胞壁)の中にいくつも入っている「緑色の丸い物体」1個1個が葉緑体です。葉緑体自身が緑色をしているということがよく分かりますね。
そんなわけで緑色をした葉緑体という「物質」が入っているから、植物は緑色に見えるということでした。
ちなみに「物質」と書いていますが、実は葉緑体は細胞内共生している別の生物だと考えられています。面白いですね。
2. 葉緑体はなぜ緑色に見えるのか?
「緑色をした物質が入っているから緑色に見える」というのは、ある意味当たり前の話です。これで終わってしまっては面白くないので、もっと掘り下げます。
次に考えたいのは葉緑体がなぜ緑色に見えるのかです。
そのために、そもそも人が物体の色を認識する仕組みについて理解する必要があります。
人が物体を視覚によって認識するためには、光の存在が不可欠です。太陽光などの環境光があるとき、その光が物体(今回の場合だと葉)にぶつかって反射します。これが人の目にある視細胞にあたると、それが電気刺激に変換されて人間の脳に伝わり、人が物体の存在を認知するわけです。
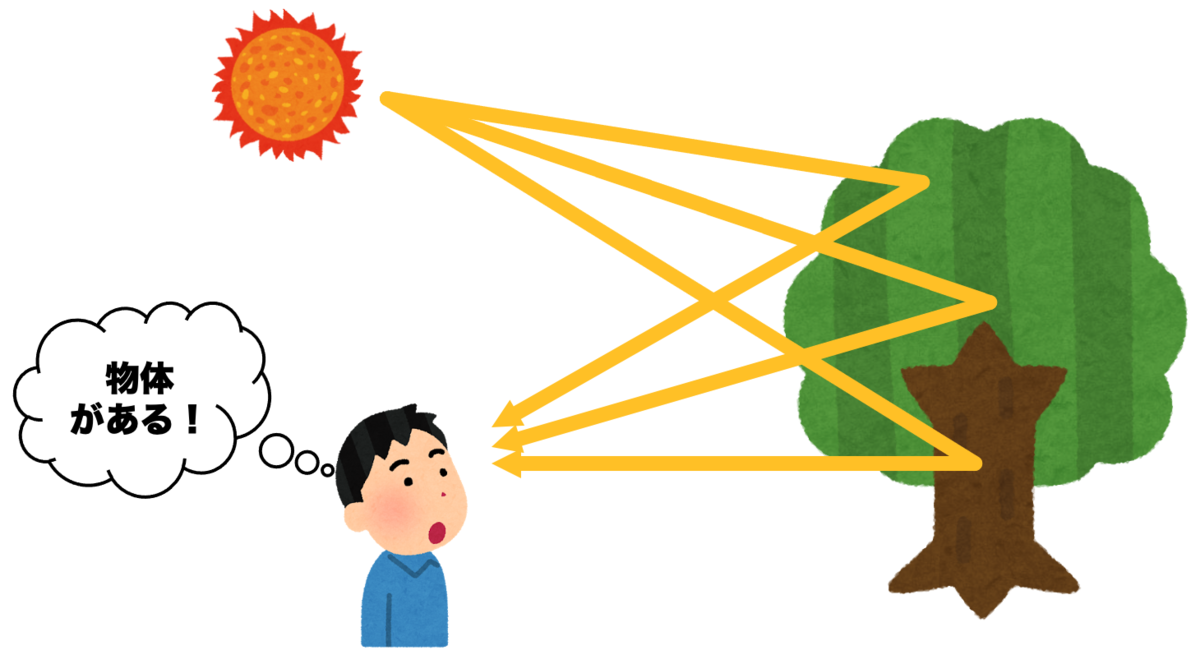
真っ暗な部屋で何も見えないのは、物体に反射させるための光がないからですね。
色を認知する仕組みはそれよりもっと複雑です。光の正体は電磁波という波であり、波長 を持ちます。我々の目が感じることができるのは 380 - 780 [nm] 程度 の波長の光だと言われています。これらの波長の光を 可視光 といいます。
人間の目には色を感じる 錐体細胞 と呼ばれる3種類の視細胞が備わっていて、それぞれ可視光域の「特定の波長の光」に反応して「青色」「緑色」「赤色」を認識します。
以上を踏まえて、各波長の可視光を見たときに人間が感じる色の対応を表すのが以下の図となります。
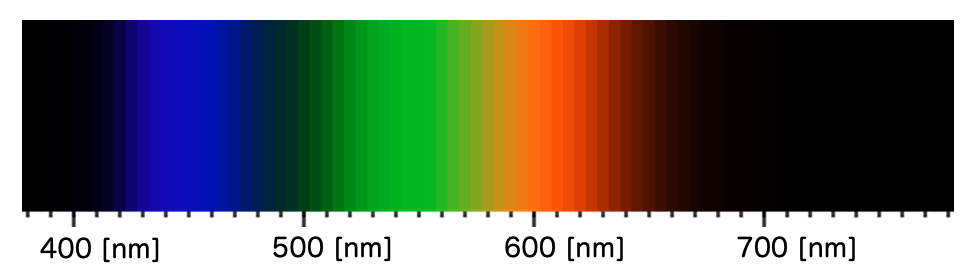
今回は、550 [nm] 周辺の波長の光を便宜上「緑色の光」のように表現します。実際は「人間がその波長の光を見たたときに緑色に感じる光」という意味です。色というのは見る側がいないと存在しえない概念なのですね。
もちろん、同じ人間であっても、色の見え方に個人差はあります。
まとめると、物体から反射する光の波長によって見える色が変わるということですね。
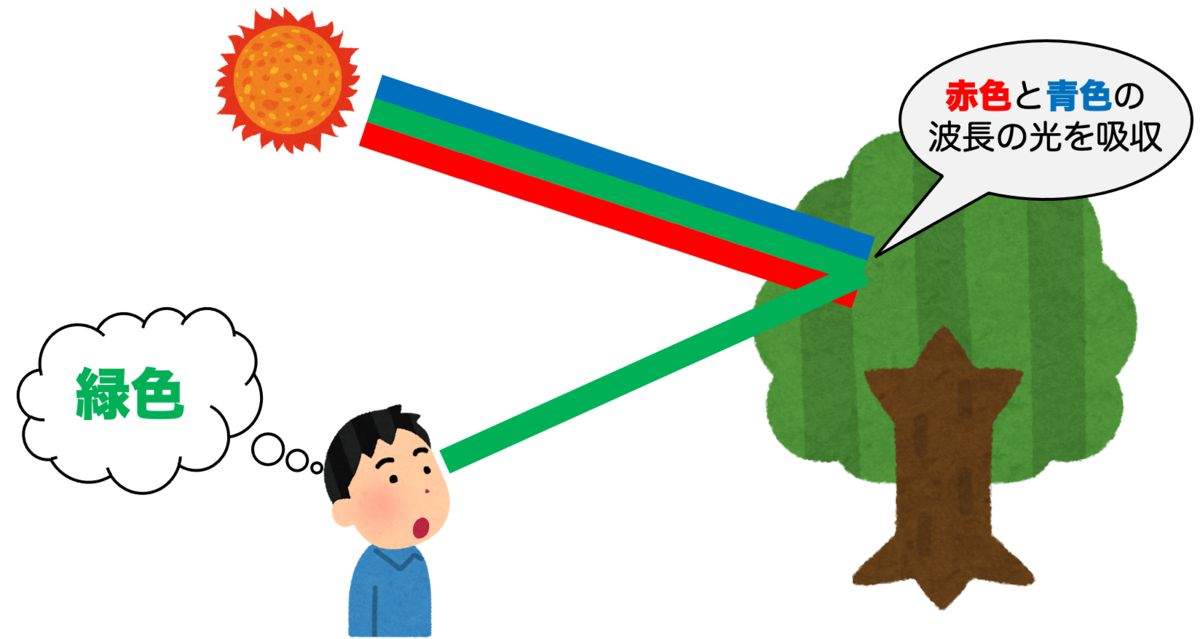
一方で、たとえば太陽から反射された光を見ているのであれば、色は太陽光に含まれる光の波長によって決まるように思えます。太陽光には、実際はさまざまな波長の光が含まれていて、それゆえに白色に見えることになります。しかし、これだけではすべての物質が白色に見えてしまうはずで、それは実際の状況とは合いません。
どのようにして物質に固有の色が生じるかというと、それぞれの物質が吸収する光の波長が異なるからです。
たとえば、赤色の光だけを吸収する物質であれば、その残りの緑色や青色が反射されるため青緑色が見えることになります。こういう色を補色といいます。
植物の葉は(つまり葉緑体は)緑色の光を反射するわけですが、それは赤色や青色といった緑色以外の波長の光を吸収するからだと言えます。
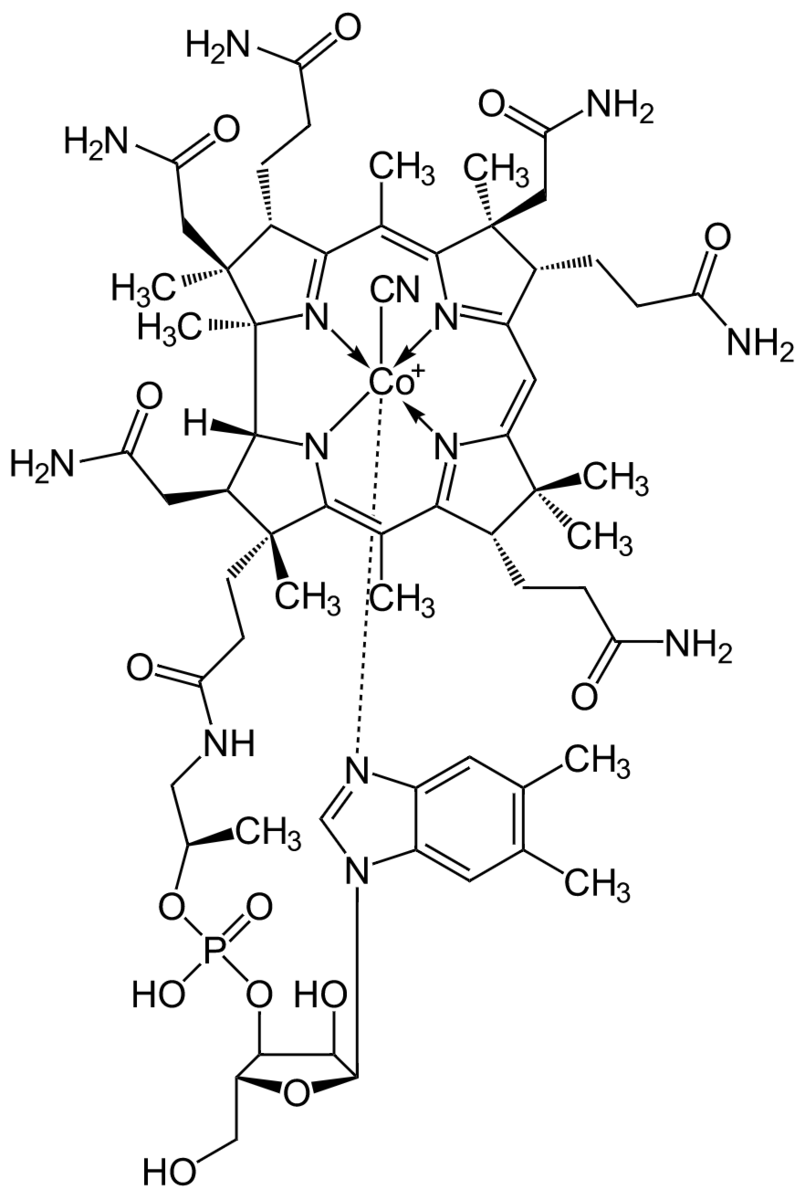
実際に、葉緑体が吸収する光の波長を分析するために、葉緑体の色素成分である、クロロフィル という物質に着目しましょう。この物質が今回の主役級の活躍をすることになります。
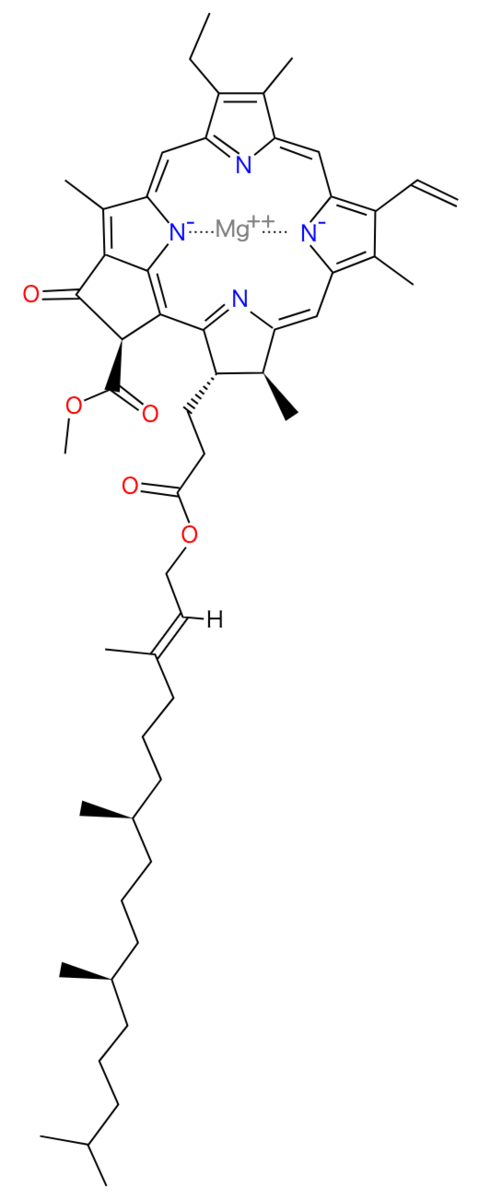
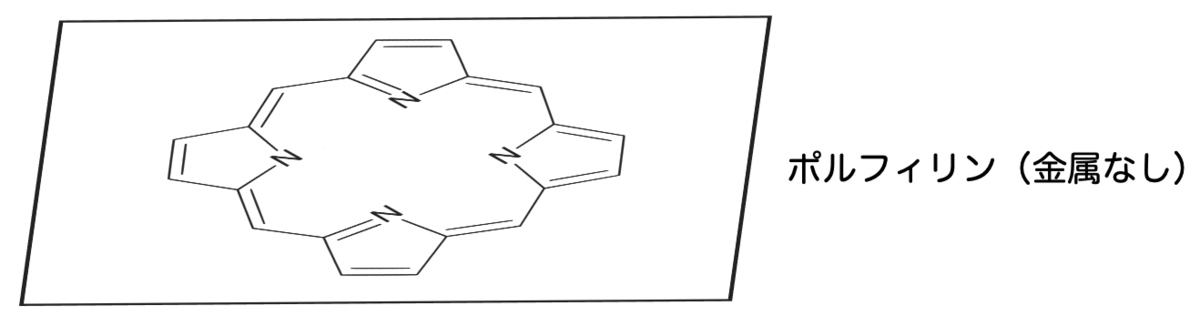
クロロフィルの分子構造は、次のような形をしています:
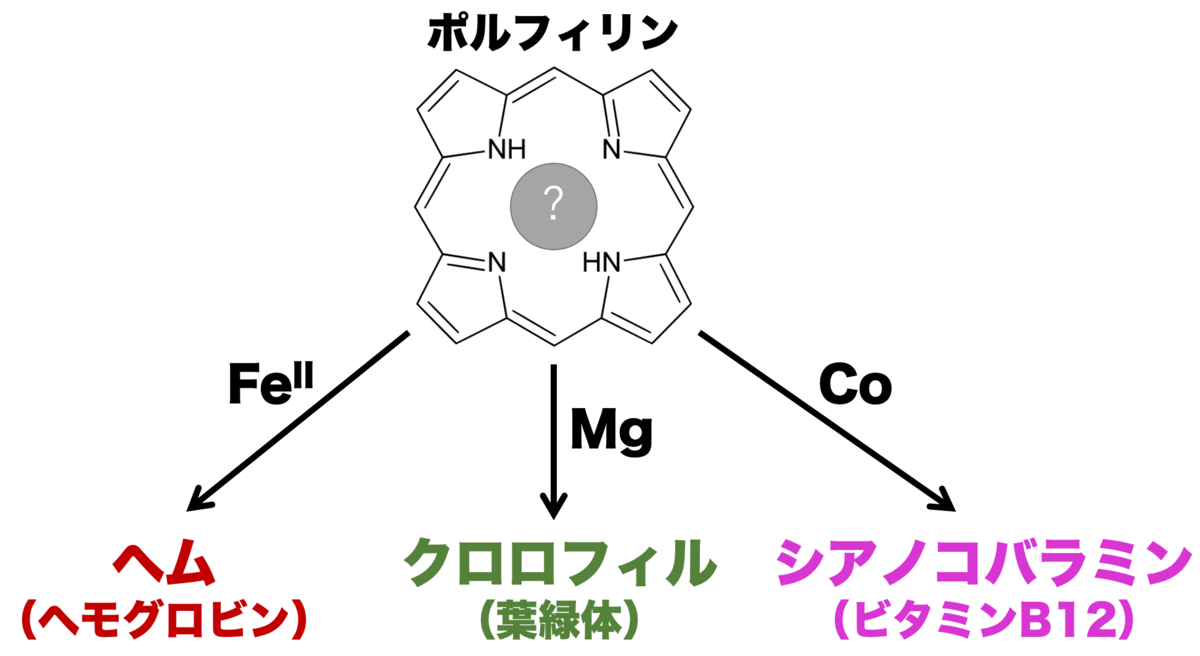
クロロフィルには ポルフィリン という分子骨格があり、その中心にマグネシウム元素が置かれています。
より正確に言えば、マグネシウム元素の周りにポルフィリンが配位結合した分子構造をしています。
あとで説明しますが、このポルフィリンの部分が 「可視光を吸収するアンテナ」 の役割を果たします。
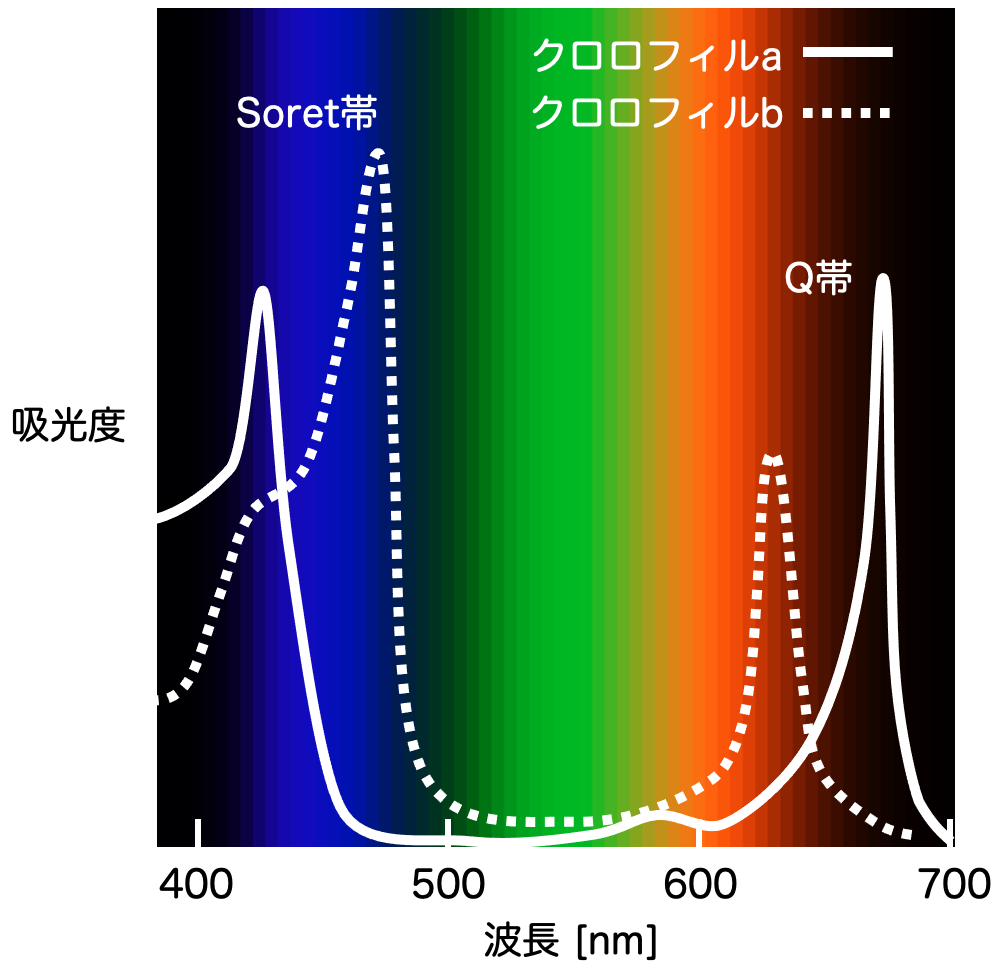
さて、このクロロフィルの吸収特性を見てきましょう。植物には、クロロフィルaとクロロフィルbという2種類のクロロフィルが多く含まれるようなので、それらの吸収特性を表したのが次の図となります。
横軸が光の波長で、縦軸が吸光度を表します。同じ強度の光を波長を変えて当てていって、そのとき物質から返ってくる光の強度を元に、吸光度を計算して得られたグラフとなっています。
グラフから分かるように、青色のところに吸収率のピークが1つできています(Soret(ソーレー)帯といいます)。つまり青色の光を強く吸収するということですね。また赤色〜赤外線のところにも吸収率のピークができています(Q帯といいます)。赤色の光も吸収するようです。
そんなわけで、クロロフィルが緑色以外の赤色と青色の光を吸収するということで、結果的に緑色の光が反射され、緑色に見えるというわけですね。面白いです!
ところで、クロロフィルが吸収する色は赤色と青色ですが、これを混ぜるとマゼンタになりますね。この色で何かピンと来る方はいませんか?
誤「マゼンダ」 -> 正「マゼンタ」
お恥ずかしながら、ずっと前者で覚えていました・・・。
植物工場の写真とかをみると、マゼンタ色の光が当てられているのをみます。
これは植物のクロロフィルがこれらの色の光を特に効率的に吸収するからです。クロロフィルに吸収された光エネルギーは 光合成 に使用されます。光合成によって、炭水化物が作られ、植物の成長に影響を与えるというわけですね。
つまり、我々が植物の葉は緑色に見えていることと、植物の重要な生育メカニズムである光合成は、大いに関係があったということになります!面白いですね!!
コメントでもご指摘いただきましたが、植物は光合成で緑色をまったく使っていないわけではありません。むしろ、どちらかというと光合成で緑色を活用しているという話があります。
クロロフィルは、緑色の周辺の光に対する吸収率が低いため、それらの光の大部分はクロロフィルを通過するわけですが、通過した光は葉の表面や裏面で乱反射します。何度も反射するうちに、一定程度クロロフィルに吸収されるというわけですね。これらの光のエネルギーは、光合成に活用されるそうです。
たとえば、以下の記事の注釈2が参考になるかと思います。
www.ccs-inc.co.jp
ところで、ポルフィリンの中心にマグネシウムが入ったのがクロロフィルだったわけですが、それ以外の金属を入れたものはまた別の化合物になります。
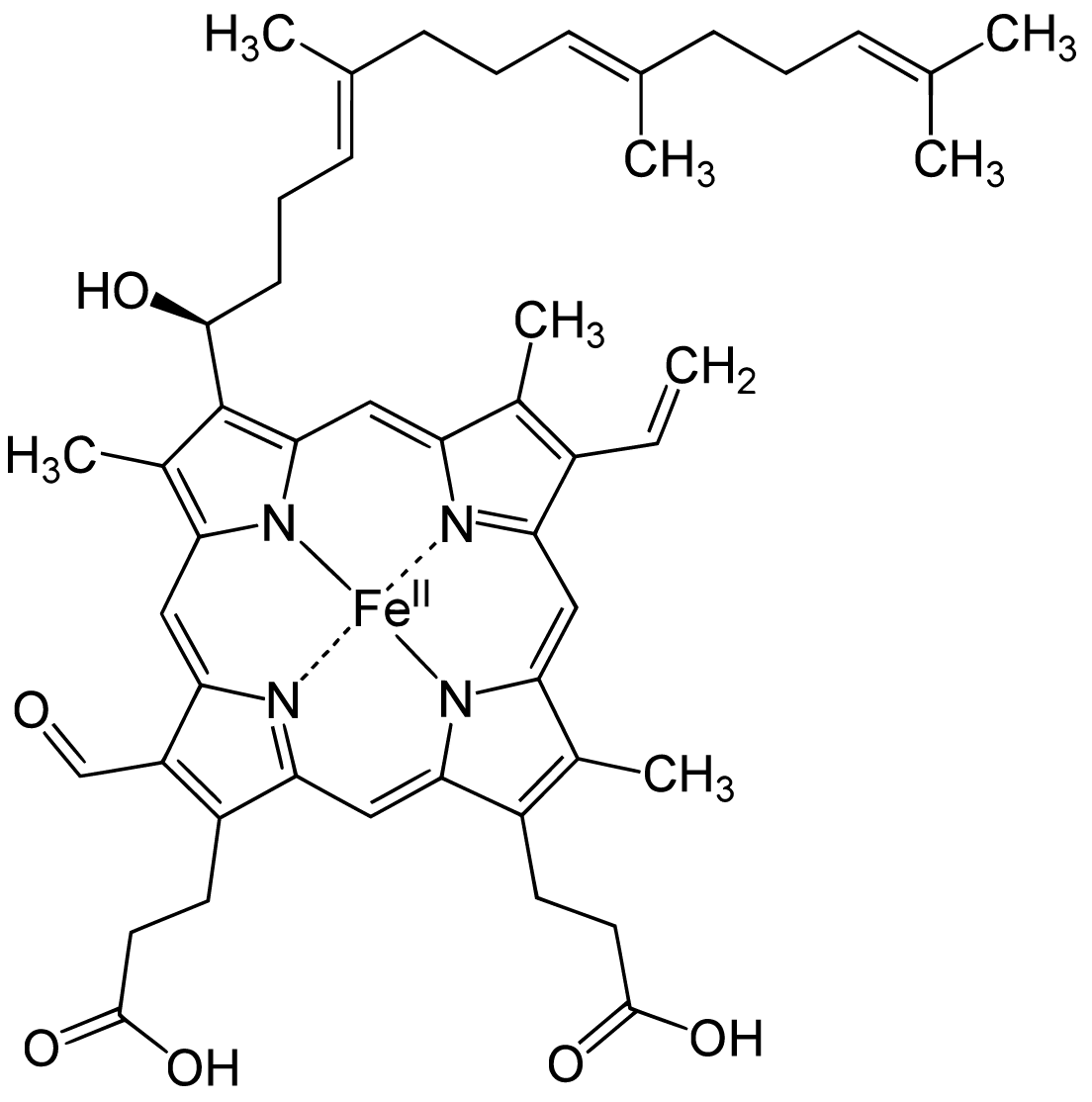
たとえば、ヘム という化合物は、中心金属に鉄元素 が入った構造をしています。
ヘムにグロビンというタンパク質がくっついたものが、みなさんよくご存知の ヘモグロビン ですね。ヘムは 赤色 をしています。
他にも、シアノコバラミン という化合物は、中心金属にコバルト元素 が入った構造をしています。
シアノコバラミンはこれまたよく知られた ビタミンB12 の一種です。シアノコバラミンは ピンク色 をしているそうです。
こんな風に、ポルフィリンは中心金属を取り替えることで異なる化合物になり得て、それぞれ生体内で重要な役割を果たしています。また、面白いことに 中心金属が変わると、それに伴ってさまざまな色を取り得る のが特徴でもあります。これは大変面白い性質で、一番最後にこの仕組みに触れたいと思います。
まとめると、こういうことですね。
以上のような話を友人にしたところ、「ポケモンのイーブイみたいだね」と言われました。
なるほど、たしかに。イーブイは、異なる種類の「進化の石」を使うことで、サンダース・ブースター・シャワーズなど、さまざまなポケモンに進化することができる特殊なポケモンです。ポケモンを知っている人には、「まさに」というたとえで、大変感心しました。
3. 量子化学を使って色の原理を理解する
ここまでの話を通して「植物が緑色に見えるのは、葉緑体内のクロロフィルが赤色と青色の波長の光を吸収するからだ」という説明をしてきました。それでは、いったいどうしてクロロフィルがこの波長の光を吸収するのでしょうか。
そもそもの話、白色以外の色が見えるためには、可視光の光のうちどこかの波長を吸収しなければなりません。可視光以外の光を吸収したとして、それは我々の色の見え方には何ら影響しないからです。可視光という比較的狭い範囲の波長で吸収しないといけないわけですね。
そう考えてみると「クロロフィルという物質が可視光を吸収する」という事実自体が大変興味深く思えてきますね。これについて何かしら理屈がつけられるのでしょうか?
この仕組みを解き明かすには 量子化学 が必要です。量子化学とは、物質内のミクロな世界の住人(たとえば電子など)の法則を考える学問です。色というマクロな現象を解き明かすのに、電子というミクロな世界の現象が関わってくるのです。これは面白そうな話です。
これまで「日曜化学シリーズ」と題して、量子化学についてのさまざまなトピック(量子力学の基礎、水素原子、原子軌道、分子軌道 etc.)を扱ってきましたが、実はどれも今回の記事のために準備をしてきたものでした。
tsujimotter.hatenablog.com
ここでは、今回の記事に必要なレベルでざっとおさらいしつつ、「クロロフィルが可視光を吸収する仕組み」について概要の説明を試みたいと思います。
あくまで今回は概要しか触れることができませんが、より突っ込んだ内容を知りたい方は、上記のシリーズを読んでいただければと思います。
3-1. 原子軌道と光の吸収
さて、今回の仕組みに関わっているのはミクロな「電子」の挙動でした。電子の量子力学的性質について、簡単におさらいすることから始めましょう。
一番基本的な状況として、原子核が1つで電子が1つの状況を考えます。水素原子の状況ですね。
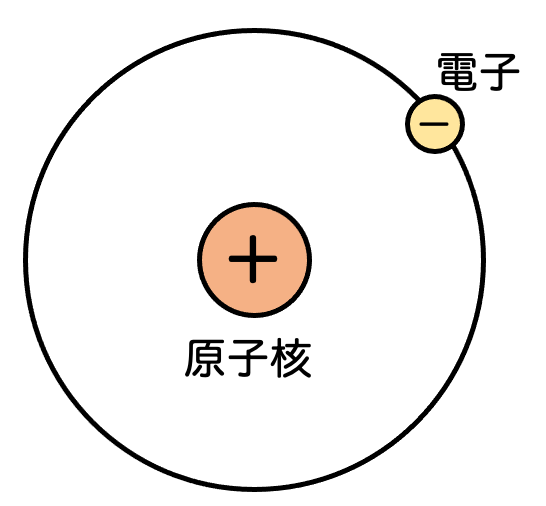
高校では、電子は原子核の周りをまわっていると教わったかもしれませんが、本当は回っているわけではありません。実際は、原子核の周りにぼわーっと広がるように分布しています。
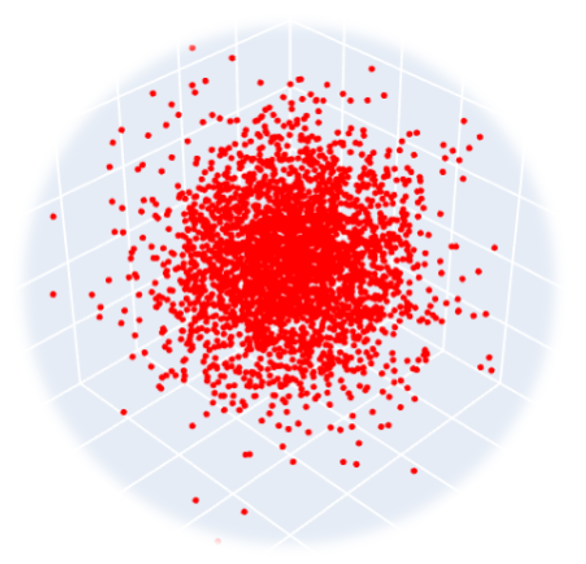
これは「多数の電子がぼわーっと存在している」ことを表した図ではありません。赤い点全部が1個の電子なのです。
どういうことかというと、電子が確率的に存在しているということなんです。電子はそもそも確定した位置を持っているわけではなく、どこにいるかはわかりません。我々の観測限界とかではなく、そもそも確率的に存在しているというのです。その確率的な分布を表すのが上記の図というわけですね。
この辺からいきなり我々の体感するスケールの物理法則とはまったく異なる様相を見せていますね。本当にこの世の出来事かと疑ってしまいますが、実際観測事実としてそうなっているということなのだから仕方ありません。ミクロな世界は我々のスケールとは異なる法則で動いているということを 受け入れるしかない でしょう。
さて、ミクロな世界の独特な法則はもう一つあって、それは 電子のエネルギーや状態は連続的ではない ということです。
電子の持つエネルギーを考えてあげると、その取りうる組み合わせは 離散的 になっています。マクロな世界であれば、たとえば物質を徐々に高い位置にもっていけば、連続的に位置エネルギーが増加していく様子を確認できますが、ミクロの世界ではそれができないというのです。
コメントでご指摘いただきましたが、「電子のエネルギーが連続的ではない」というのは、今回のように電子が原子核内にいるなど「特定の空間に収まっている」条件下で、シュレーディンガー方程式を解いたときに導かれる事実です。このような状況を「束縛されている」といったりします。
こういう結果がシュレーディンガー方程式から自然と導かれるというのは不思議なことですね。(なお、今回は具体的な計算はするつもりはないので、こちらの記事や他の参考書等をご確認ください。)
たとえば、水素原子の例では次のようなエネルギーを取ります:
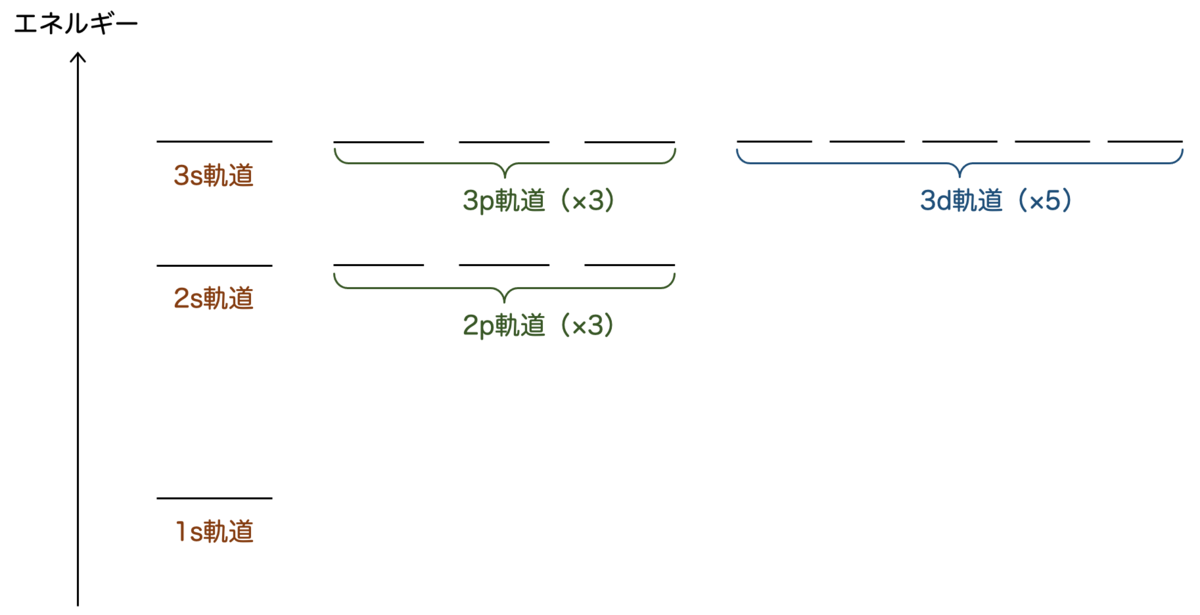
各エネルギーに対応して、電子の取りうる分布が決まっているというわけです。これを 原子軌道 といいます。(あるいは単に「軌道」といいます。)
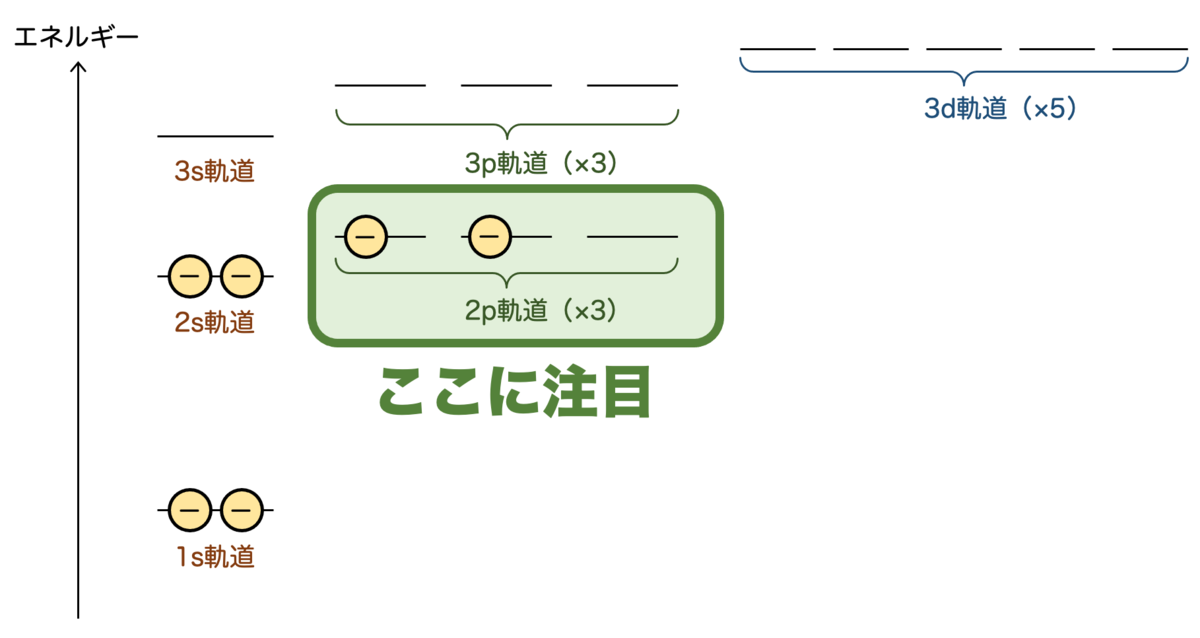
それぞれの軌道には名前がついていて、エネルギーが低い順に1s軌道、2s軌道、2p軌道、3s軌道、3p軌道、3d軌道、・・・のようになっています。対応する電子の分布の形は次の通りです:
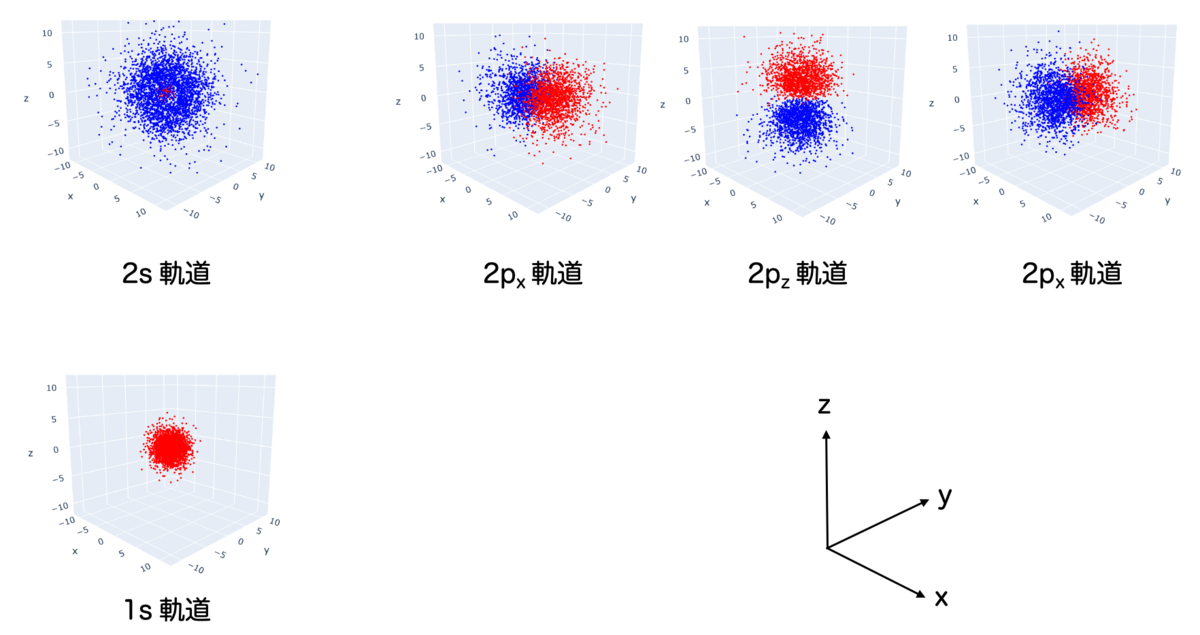
とにかく、水素原子核の周りにいる電子は、上に書いたような状態しか取りえないというのが結論です。
ところで、今「水素」に限定して考えているような説明をしていますが、少しの修正を加えれば、他の原子でも同じことをいうことができます。なので、上に書いた原子軌道は、他の元素、たとえば炭素原子などでも同じように存在します。有機化学においては、主役は炭素なので、これからは炭素を中心に考えます。
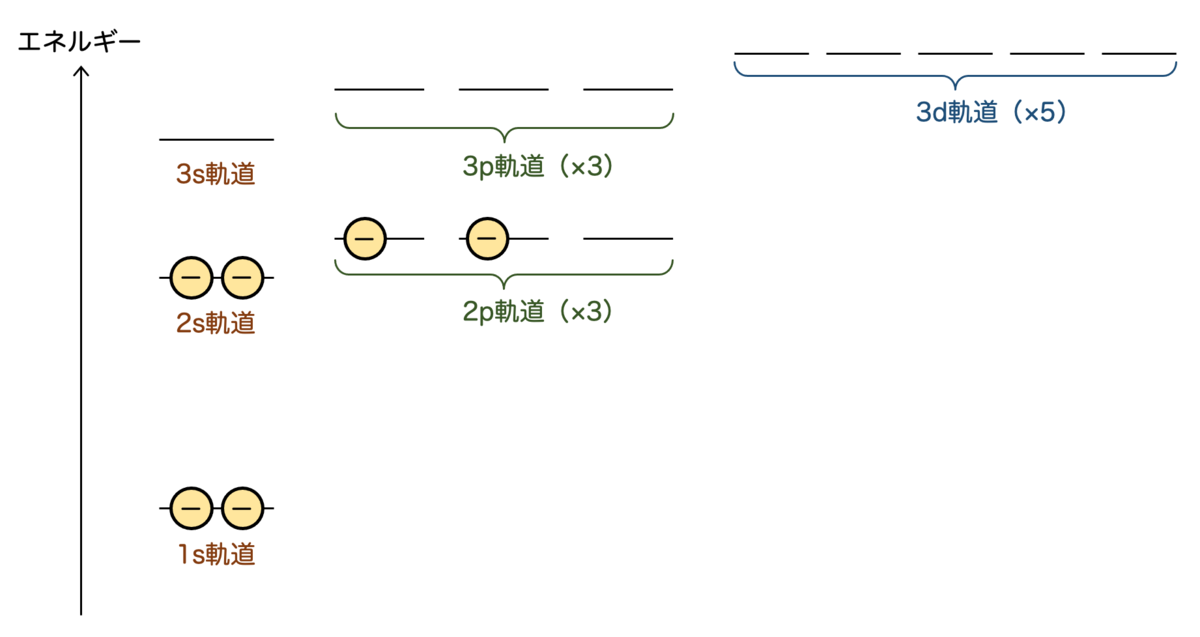
炭素は原子番号6の元素なので、炭素には電子が6個ある ことが知られています。
これらの電子は上に書いた原子軌道のどれかを取ることになりますが、好きな軌道を自由にとれるわけではありません。基本的には、エネルギーが低い状態を取ることになります。
そうなると「6個の電子がすべて一番エネルギーが低い1s軌道に居るのか」と思ってしまいそうですが、実はそうではありません。電子には、どうやら「他の電子とは同じ軌道に入りたくない」という性質があるそうで、同じ原子軌道に入る電子は最大2個まで と決まっています。
そこで、エネルギーが低い順に2個ずつ入っていき、次の内訳で格納されることになります:
- 1s軌道 2個
- 2s軌道 2個
- 2p軌道 2個
この状態が一番安定している状態で、基底状態といいます。
逆に、炭素に「なんらかの力が働いて」電子がより高いエネルギーの軌道に移ることがあります。こういう状態を励起状態といいます。
「なんらかの力が働いて」ってなんだよと思ったかもしれません。重要な例を1つ挙げると、光が入射されたとき です。
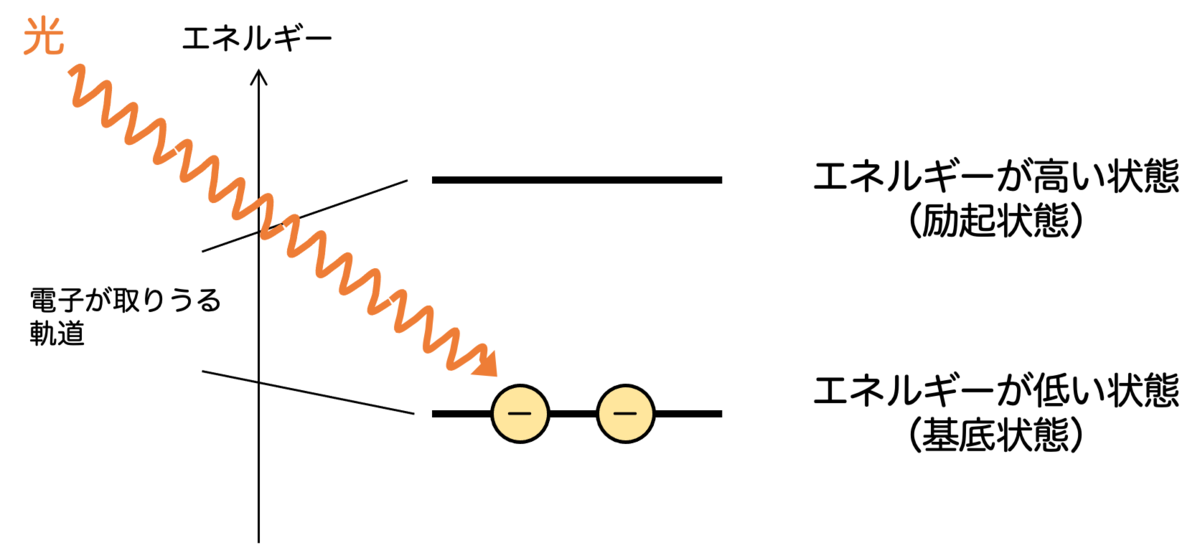
光が入射されると、電子がエネルギーを受け取ってより高いエネルギーの軌道に励起することがあるのです。
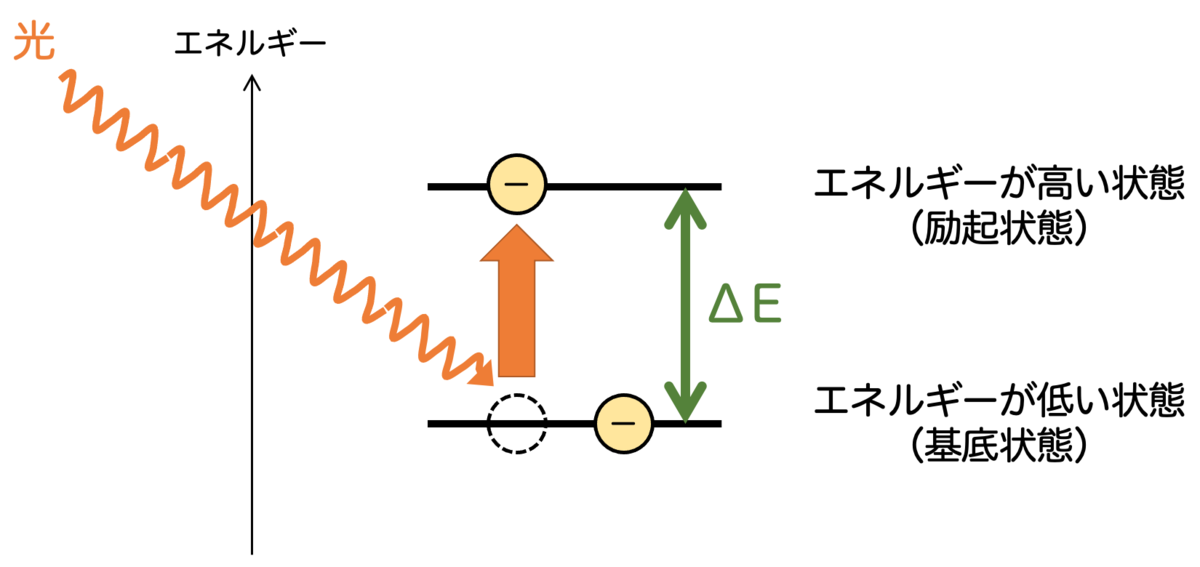
ただし、どんな光でも吸収できるわけではありません。電子の取りうるエネルギーは決まっているという話をしました。つまり、基底状態と励起状態のエネルギーの差 が、ちょうどぴったり光のエネルギーと一致しない限り、電子は光を吸収することができないのです。(ここ重要)
光のエネルギー は、プランク定数
と光速
という定数と、光の波長
を使って
と表せます。光のエネルギーは波長によってのみ決まり、エネルギーと波長の間にはちょうど反比例の関係があります。
波長が長くなれば、光のエネルギーが小さくなります。逆に波長が短いと、光のエネルギーは大きくなります。
したがって、軌道間のエネルギー差がちょうどよいものが存在すれば、対応する波長の光が吸収されることになりますね。
3-2. 分子軌道
残念ながら、クロロフィルの可視光吸収を考える上では、炭素原子単体を考えるだけでは不十分です。ここからは 分子 を考えていきたいと思います。
上の説明では、すべての軌道の電子が光からエネルギーを受け取って励起するという説明でしたが、実際一番吸収しやすいのはエネルギーが高い軌道です。つまり、炭素原子の場合は、2p軌道にある電子が一番反応しやすいということです。そこで、2p軌道に注目して考えましょう。
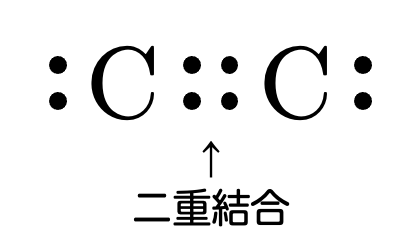
たとえば、エチレンという分子を考えてみましょう。エチレンは炭素原子2つによる結合で、2p軌道にある2つの電子が互いに手を取り合い二重結合を形成しています。
2p軌道は全部で3つありますが、どれも直交していて、それぞれ 軸方向を向いています。ここでは
と
の二つが結合に関与していると考えましょう。
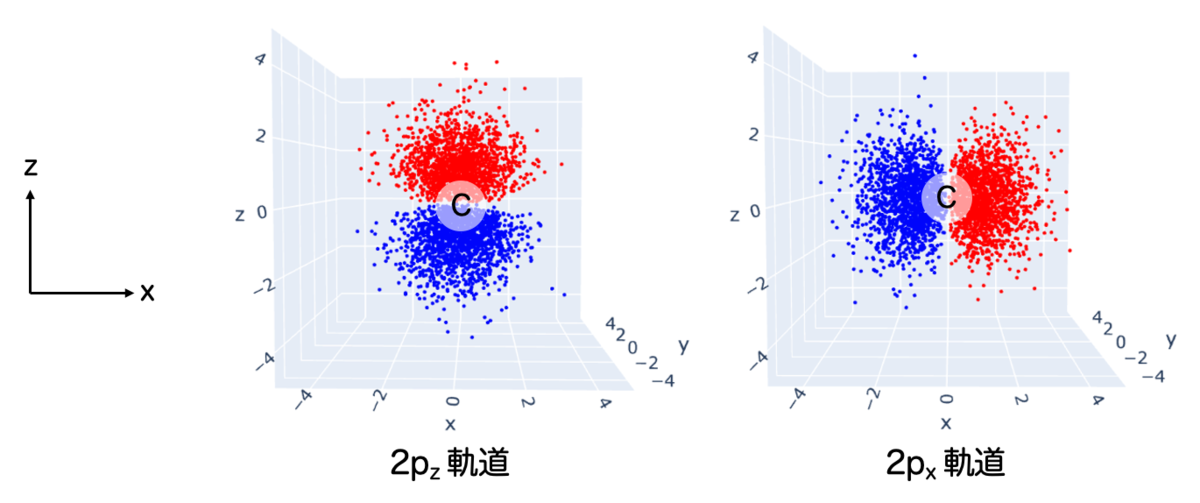
(図は原点に炭素原子核 C がある想定です。)
まず、炭素原子核がx軸上にあると仮定して、原子核が近づいていく状況を考えます。それぞれの 軌道同士が結合すると、電子分布はこのようになります。
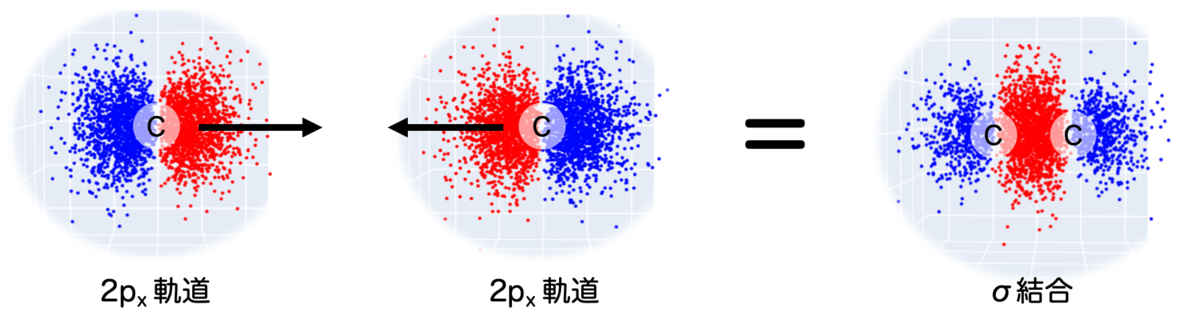
分子が取りうる電子の分布のことを 分子軌道 というのですが、分子軌道は個々の原子軌道の分布が重なり合った形で表現されます。
ちょうど、炭素間に電子の分布が集中しているように見えますが、実際このような形で結合が形成されるのですね。これをσ結合といいます。
一方の、 軌道同士はどうでしょうか。これは
軌道とは垂直の方向に向いた原子軌道同士の結合です。
これらも結合に関与していて、実際このような分布になります。
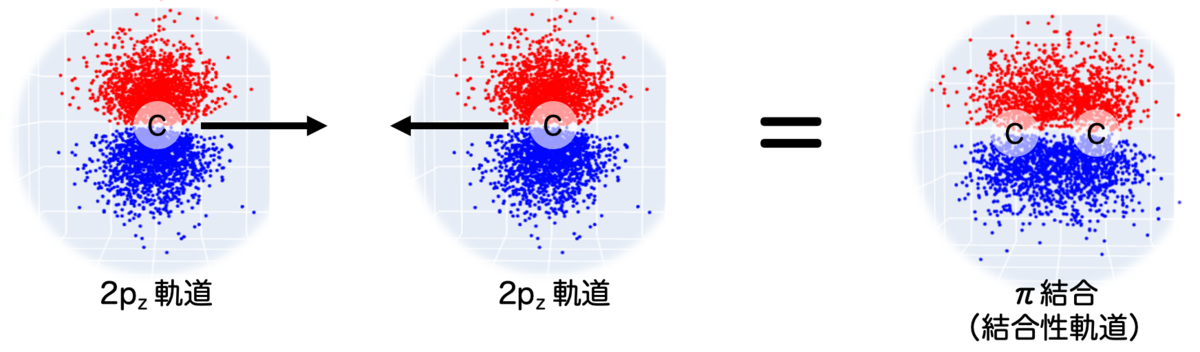
軌道の上側の部分と、下側の部分がそれぞれくっついたような形で結合が形成されていますね。これを π結合 といいます。
こんな風に、エチレンの炭素間には、σ結合とπ結合という2種類の結合が形成されているわけですね。
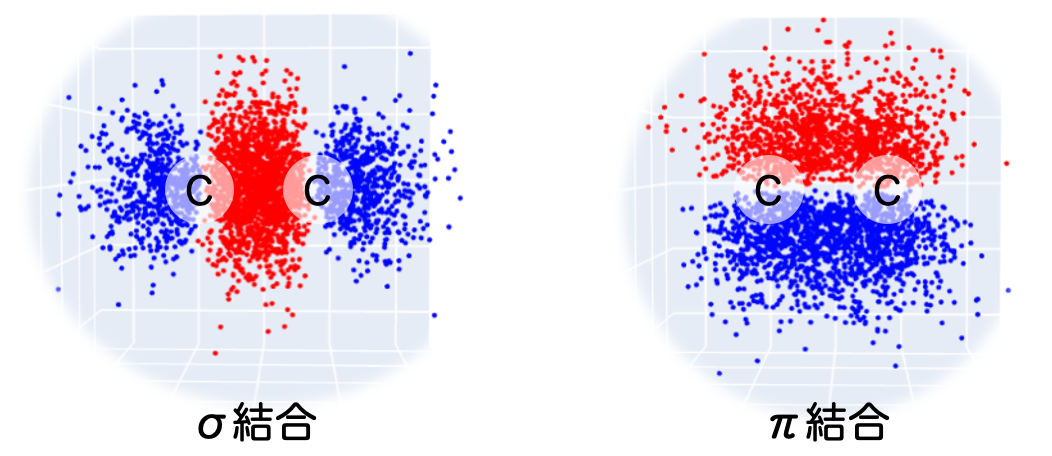
分子軌道の形からして、π結合の方が不安定なのが分かるかと思います。つまり反応しやすいのはπ結合を形成する電子というわけです。こういう電子をπ電子と呼ぶことにします。
というわけで、以下ではこのπ電子に注目したいと思います。π電子に光が入射されるとどうなるかを考えていきたいわけです。
ところで、π電子の分子軌道は

の形しかないような説明をしていました。この軌道を結合性軌道といいます。
実は、もう一つ安定した軌道があります。これを反結合性軌道といいます。
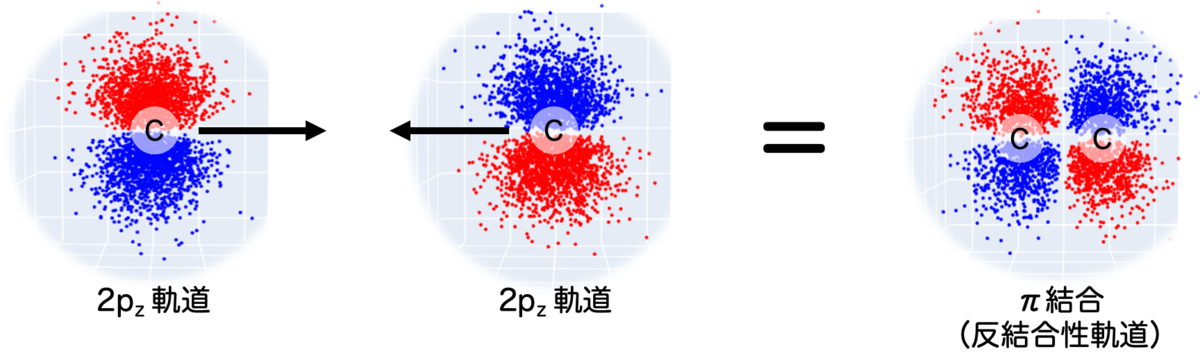
軌道には「符号」がついていて、
軸の正方向と負方向のどちらか一方が
で、もう一方が
となります。同じ方向に
が集まって結合したのが結合性軌道で、
と
で結合したのが反結合性軌道となっています。
反結合性軌道の方が相対的にエネルギーが高くなります。
2つの分子軌道(結合性軌道/反結合性軌道)が登場したわけですが、原子軌道において 軌道だったものが、原子が近づくにつれてエネルギーの異なる2つの分子軌道に分かれる、というようなイメージで捉えていただければと思います。
tsujimotter.hatenablog.com
とりあえず、ここではエチレン分子の分子軌道が、エネルギーが異なる2つになるということがわかれば十分です。
さて今、π電子は各原子核から供給された2つあって、エネルギーの異なる分子軌道が2つあります。ここでも「各軌道に電子は2つ」の法則は残っていて、π電子はよりエネルギーの低い結合性軌道の方に入ります。

これが基底状態というわけですね。やはり何かしらちょうどよいエネルギーが与えられると、π電子は反結合性軌道に移ることになります。これによりπ結合が切れることがあります。
3-3. π電子共役系
ここからが面白いのですが、炭素原子の結合を増やして、π電子の数を増やしてみたいと思います。
π電子を増やすためには、二重結合を考える必要があります。たとえば、ブタジエンを考えましょう。
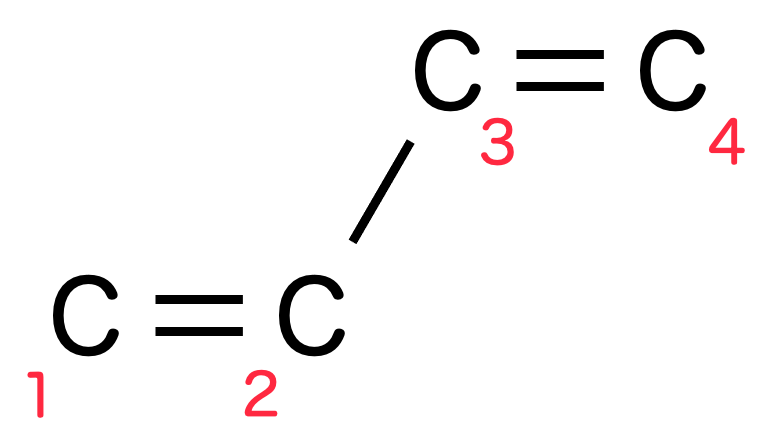
ブタジエンを構成する炭素を左から1, 2, 3, 4と名付けると、1-2, 3-4間で2つの二重結合があります。π電子は1-2間、3-4間にそれぞれいるように思うかもしれませんが、実際は分子全体にいることになります。
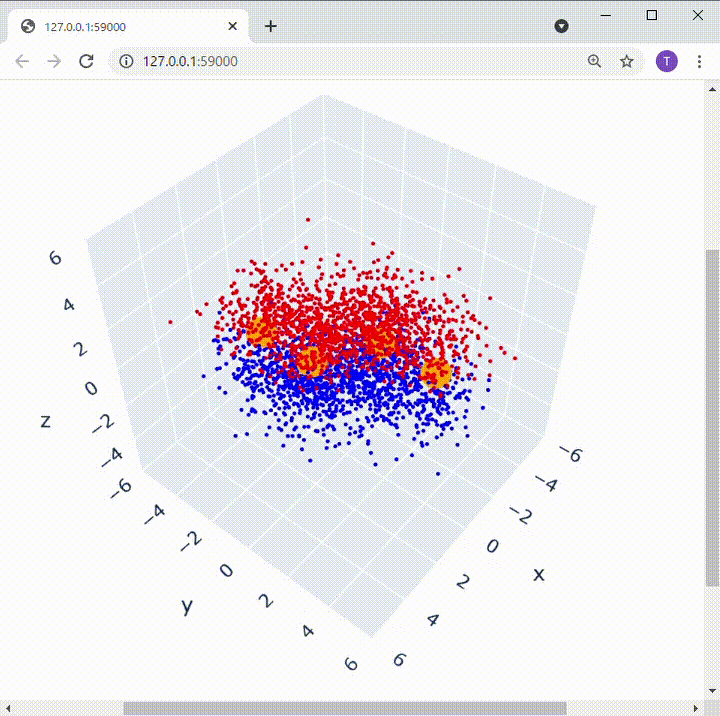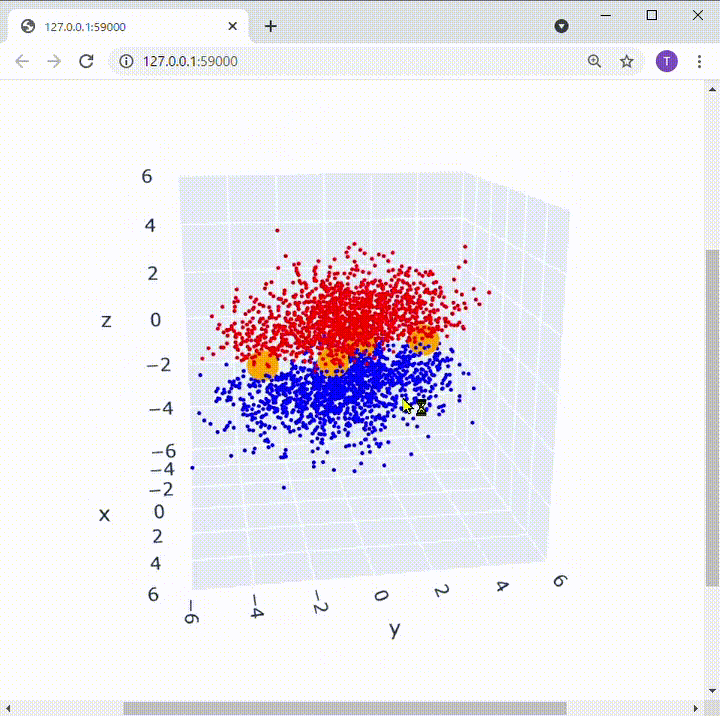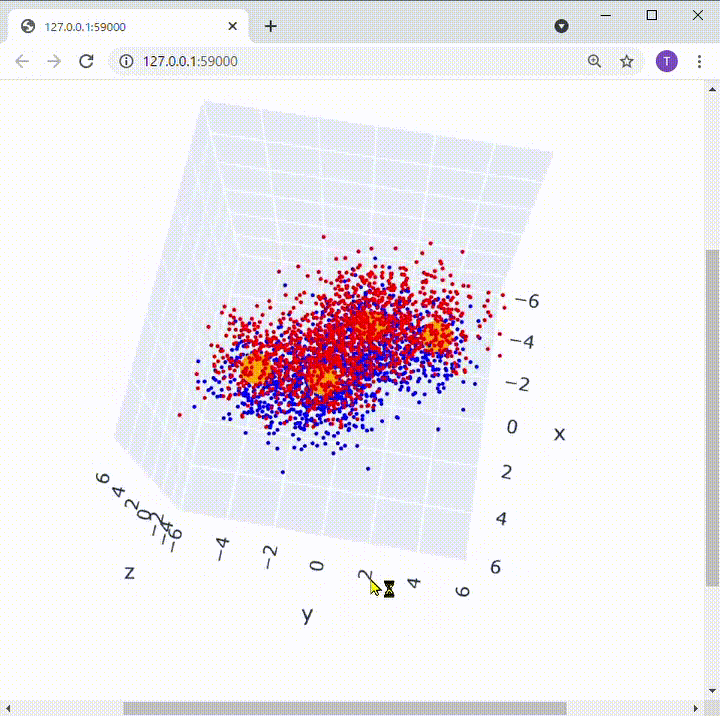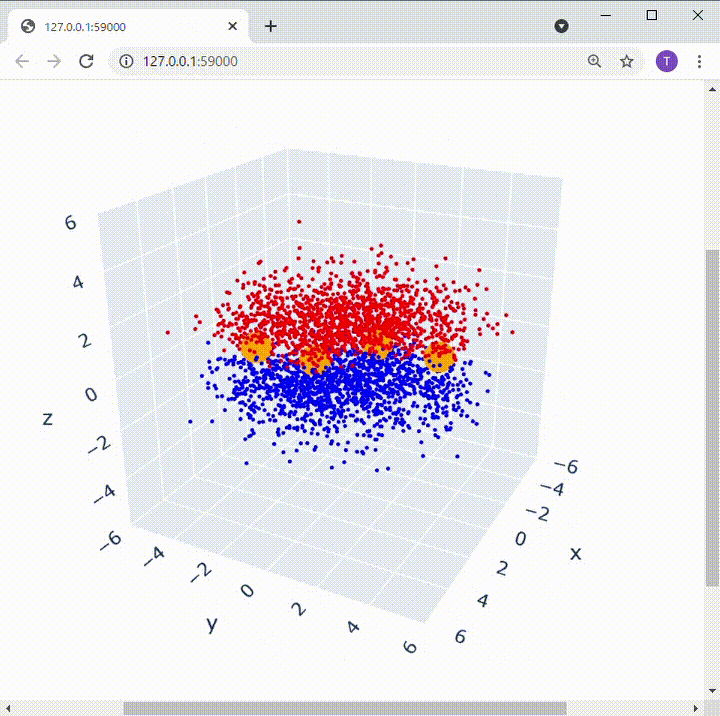
[オレンジ色の部分が炭素原子核の位置、赤と青の部分が電子の分布]
こんな風に、全体に 「非局在的」 (局所的に存在しているわけではないということ)にπ電子が存在している系を π電子共役系 といいます。
ブタジエンは、4つの炭素原子から各1つずつ出ている 軌道によるπ電子共役系を形成しています。このような条件で分子軌道を考えると、エチレンからさらに軌道が増えて全部で4つのエネルギーを持つ分子軌道ができます。
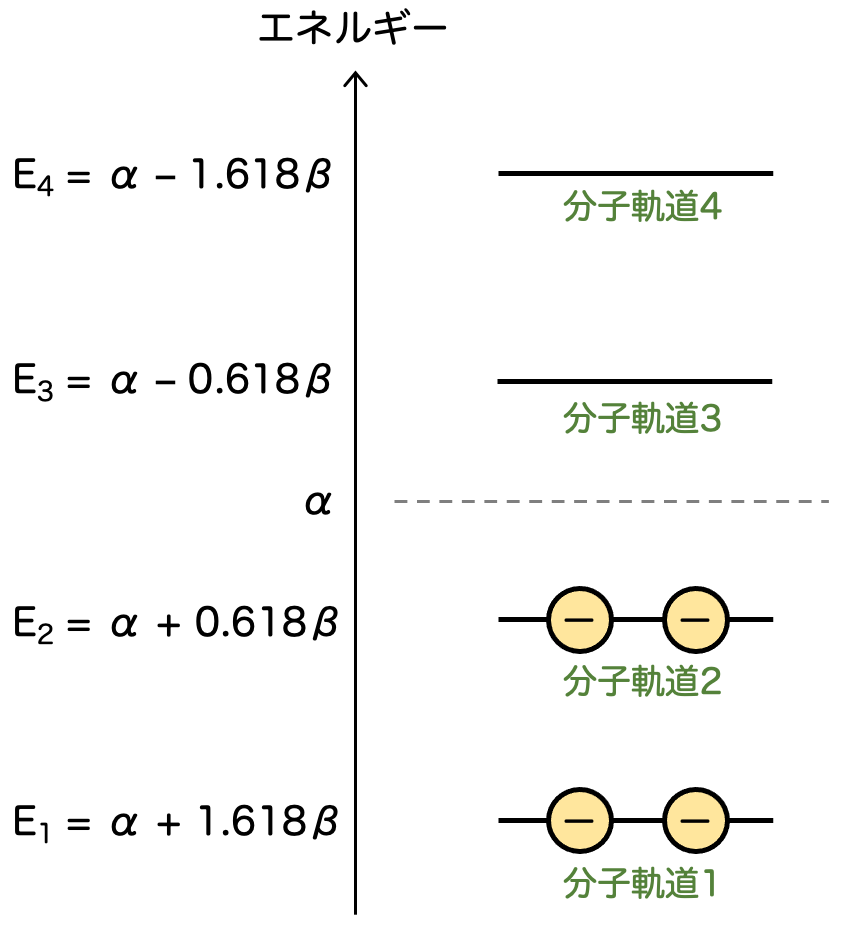
ここで「各軌道に電子は最大2つ」の法則を思い出すと、π電子は全部で4つなので、下の2つの軌道にそれぞれ2個ずつ入って安定します。これが基底状態です。
基底状態の電子にちょうどよいエネルギーが供給されると、より高いエネルギーの分子軌道に励起することもあります。
基本的には、π共役系の大きさが増えれば増えるほど、取りうる分子軌道の個数が増えることになります。二重結合をどんどん増やしていくと、次の図のようになります。
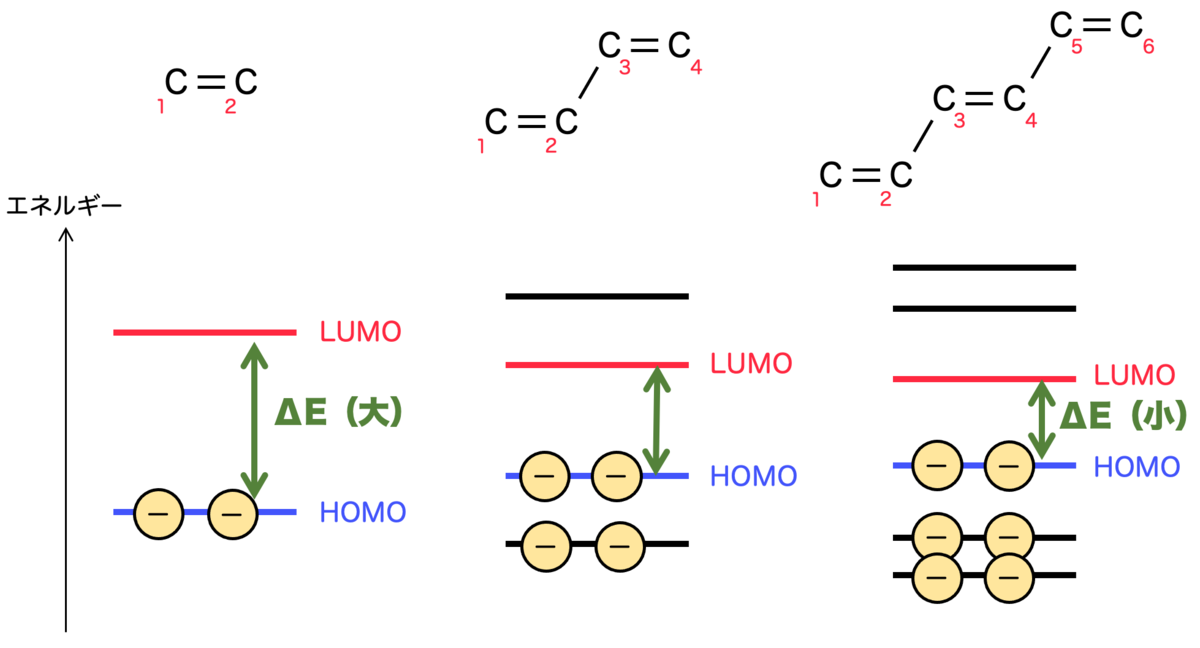
ここで、HOMO-LUMO(読み方は「ホモルモ」)という言葉が出てきたので少し説明します。
HOMOとは、電子が充填された軌道の中で最もエネルギーが高い軌道を指す言葉です。逆に、電子が空であるような軌道の中で最もエネルギーが低い軌道がLUMOです。
HOMOの電子は一番エネルギーが高い電子なので、一番反応がしやすいです。その電子が、エネルギーをもらって高い軌道にあがるときに、一番行きやすい(一番エネルギーが小さくて済む)のがLUMOというわけです。
そこで、HOMO-LUMOの間のエネルギー差 に着目したいというモチベーションが生まれるわけですね。
ここで、先ほどの図をもう一度見ます。

右に行くにしたがってπ電子共役系が大きくなるわけですが、これによって軌道の個数が増えていきます。電子は基本的に半分から下にすべて納まるので、HOMO-LUMOの間隔 はどんどん小さくなっていくわけですね。
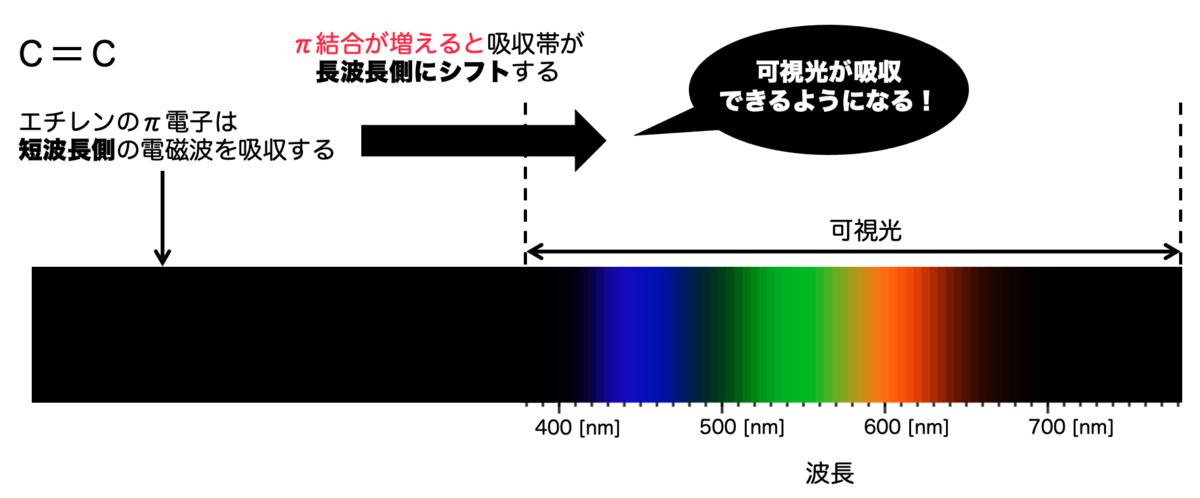
したがって、ここでの結論は π電子共役系が大きくなればなるほど、エネルギーがより低い光を吸収できるようになる ということです。
光のエネルギーが低いということは、
より、波長は長くなるということになります。つまり、波長がより長い光を吸収できるようになる ということになります。
エチレンのπ電子による吸収は、可視光より波長が短いので、可視光を吸収しません。そこで、よりπ電子共役系が大きな分子の中に、可視光を吸収できるものがあると期待できますね。
4. ポルフィリンが可視光を吸収するのはなぜ?
以上のことから、クロロフィルが可視光を吸収する理屈について考えてみましょう。
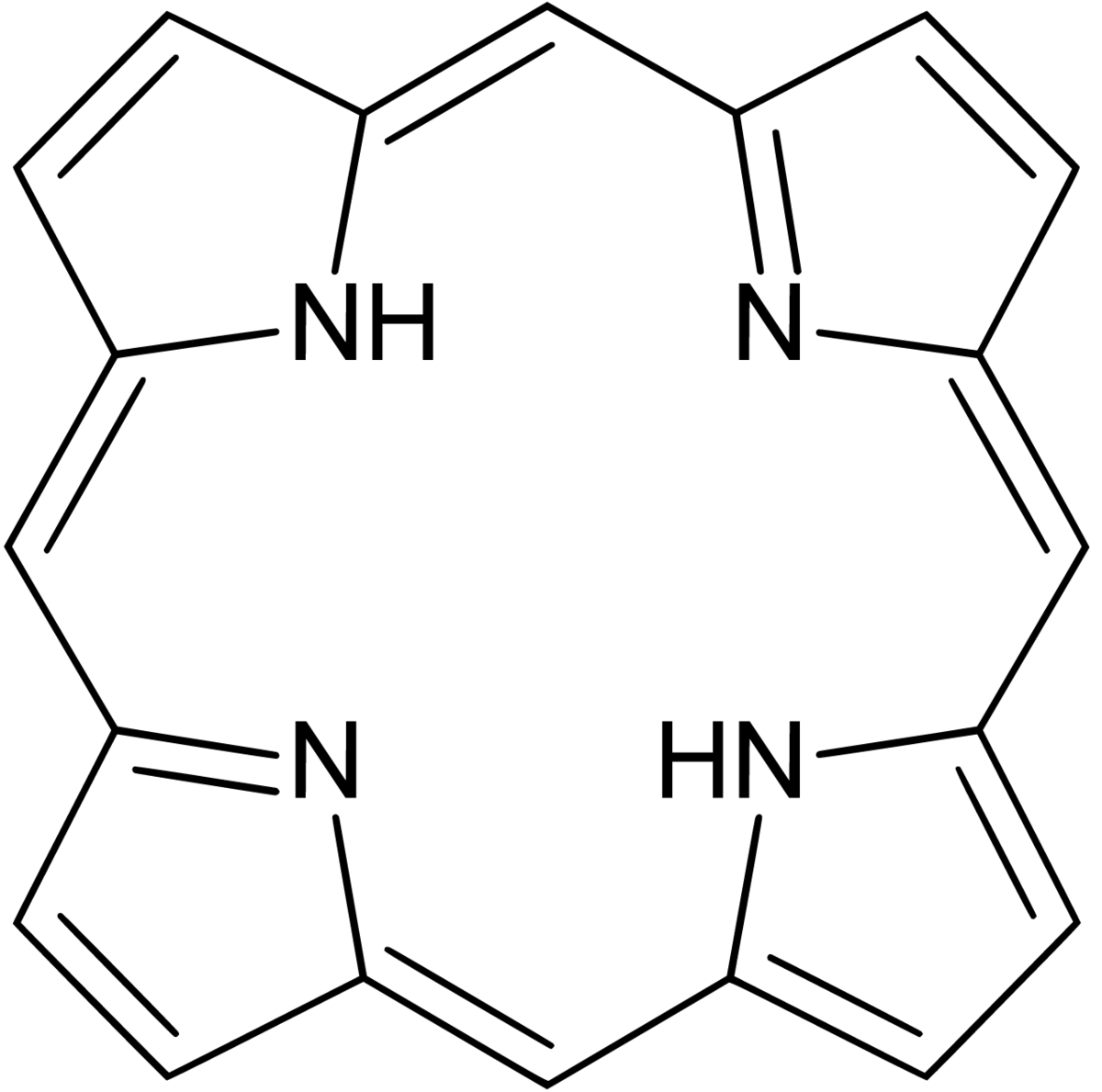
まず、クロロフィルの骨格にある ポルフィリン という構造に着目します。
ポルフィリンはまさに二重結合と一重結合が交互に並びながら環を作る構造 となっていますね!
つまり、全体がπ電子共役系になっている というわけです。
先ほど、π電子共役系が大きくなればなるほど、吸収できる波長が長くなるという話をしました。波長が長くなることで可視光が吸収できるようになることが期待されます! さぁ、面白くなってきました!
実際、そうなっています! ポルフィリンの吸光特性を見てみると、こうなります:
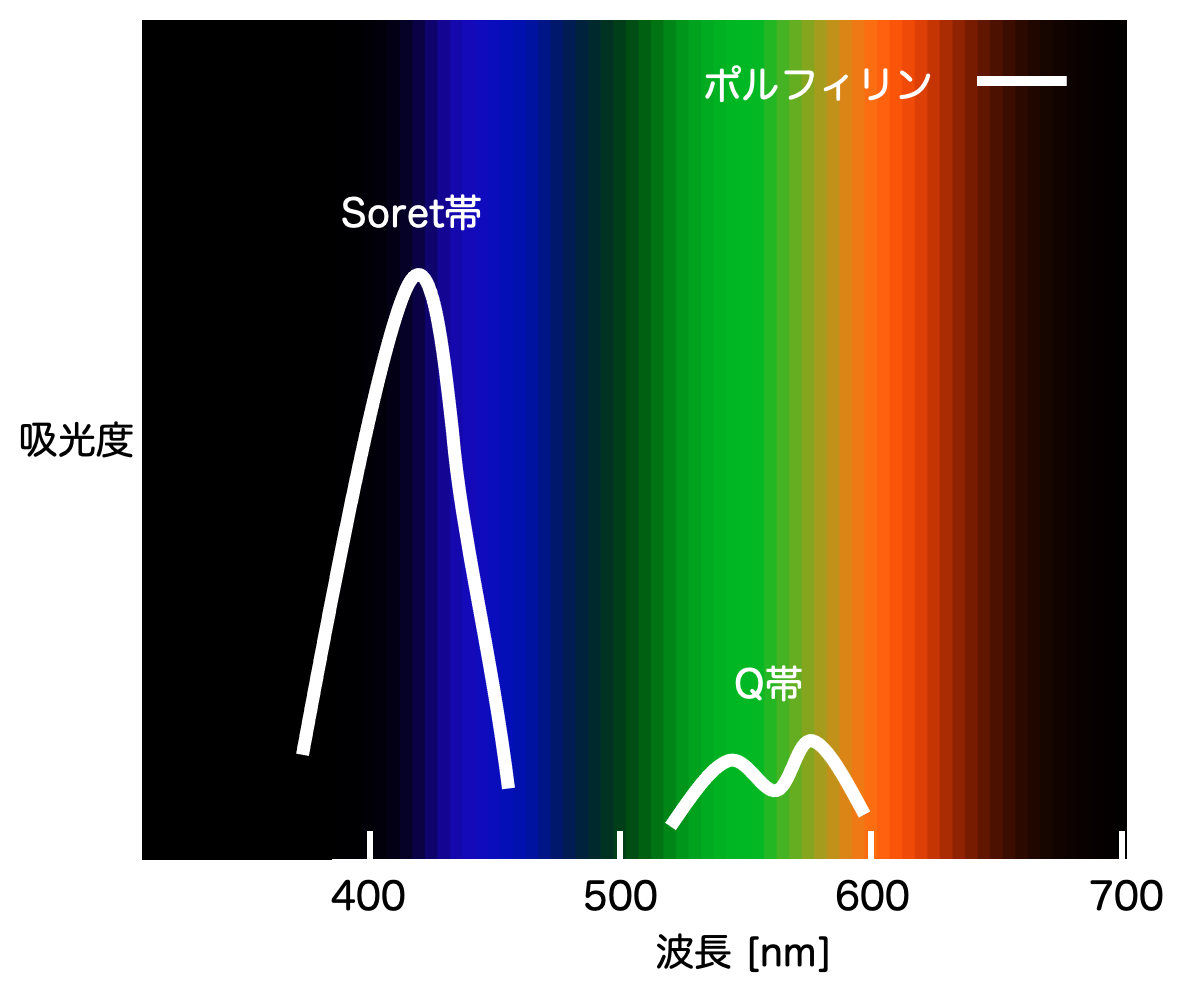
[ポルフィリンの吸光特性(ただし、これは下記キリヤ化学様のサイトの画像を参考にtsujimotterが作った【不正確な】図です。)]
www.kiriya-chem.co.jp
もちろん、図には著作権がありますので、トレースしたり改変したり等は難しいです。そこで、キリヤ化学様の画像の大まかな特徴を観察して、フィーリングで書いたものとなっています。
図を見てわかる通り、不正確な図となっておりますので、正確な情報は上記のサイトをご覧いただければと思います。
確かに、青〜紫の波長と、緑〜黄の波長の光を吸収する特性が見られます。前者をSoret帯(ソーレー帯)、後者をQ帯といいます。要するに、可視光が吸収できるというわけですね。
つまり、ポルフィリン骨格が可視光を吸収するアンテナになっている、ということが分子軌道の観点から説明ができたというわけです!
面白いですね!
5. クロロフィルはなぜ緑色以外の波長の光を吸収するのか?
以上はポルフィリン骨格単体の話でした。では、ポルフィリン錯体の中心金属の果たす役割はどのようなものなのでしょうか。
クロロフィルはマグネシウムが中心金属となっていました。他にも、鉄が入るとヘム(ヘモグロビン)に、コバルトが入るとシアノコバラミン(ビタミンB12)になるのでした。どれも色が異なって見えます。
ポルフィリンの各元素は平面内に配置されています。これによりπ電子が全体に非局在化してπ電子共役系を形成します。
一方、金属元素がポルフィリンの骨格の中心に入ると、その骨格の構造に「歪み」が生じます。
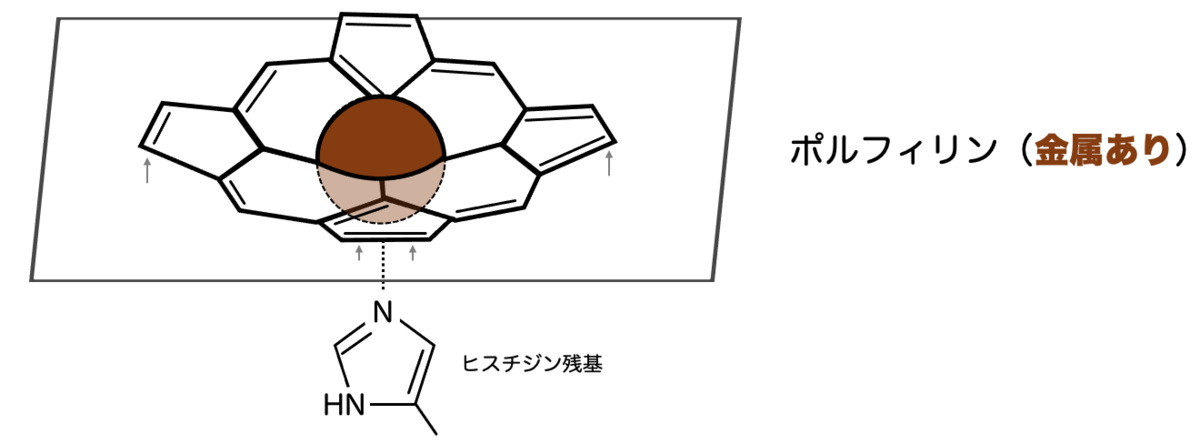
より正確にいうと、金属元素にはポルフィリンが4方向から配位していますが、さらにもう1つ下方向からヒスチジン残基が配位します。
すると、ヒスチジン側が金属元素を引っ張ることにより、金属元素の中心は平面よりやや下に飛び出します。これによってポルフィリン環は全体的に上方向に「くぼむような」構造になります。
https://www.jstage.jst.go.jp/article/jscrp/50/2/50_KJ00010115793/_pdf
要するに金属に配位することで平面的な構造が崩れ、これがπ電子共役系に影響が出るということです。これにより吸収波長のピークが変わるというわけですね。
実際、ポルフィリンの吸収特性と、クロロフィルの吸収特性を見比べてみるとこうなります:
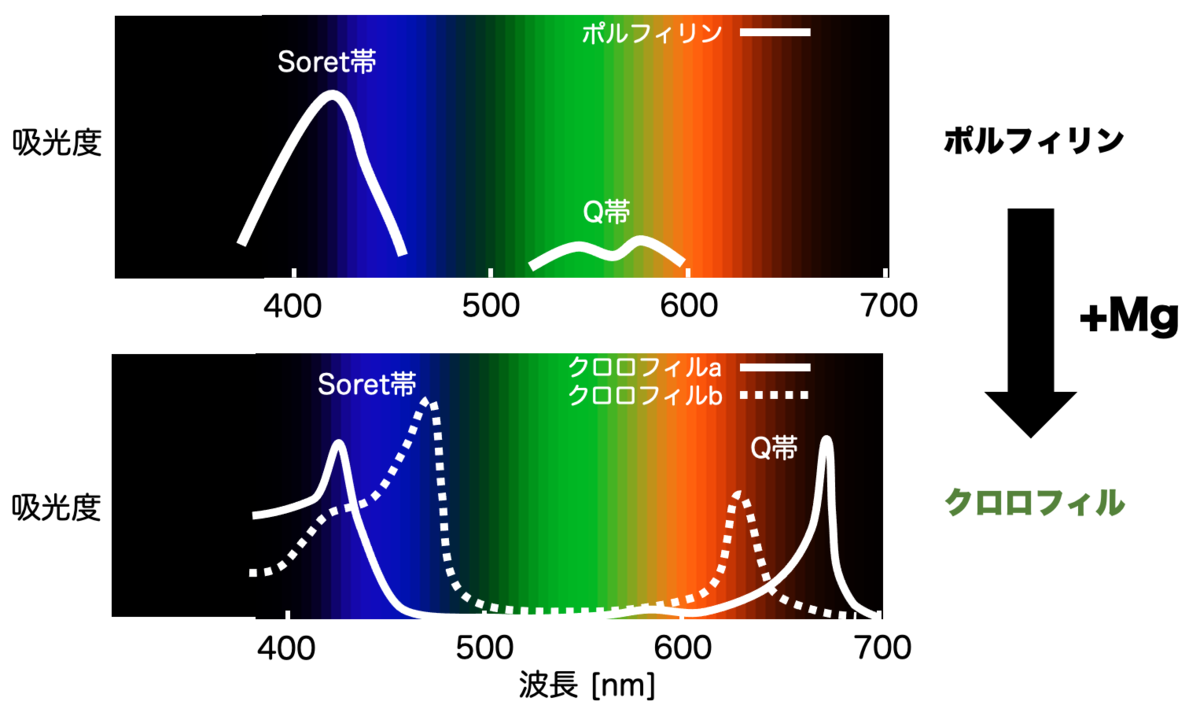
たしかに吸収率のピーク波長がずれていることがわかりますね。
特に、クロロフィルbについては、Soret帯の波長がより高波長にずれることによって 青色を吸収 するようになっています。
また、Q帯の吸収率が上がっており、これにより 赤色をより強く吸収 するようになっています。
これらの吸収特性は 中心金属(この場合はマグネシウム)による影響だった というわけです。
さらにいうと、その歪み方の程度は中心金属によって異なります。
これこそが、ポルフィリンの中に異なる金属を入れた物質(クロロフィル、ヘム、シアノコバラミン etc.)で、それぞれ色が異なる理由だったわけです!
めちゃめちゃ面白いですね!!
せっかくなので 血液の色 にも触れたいと思います。
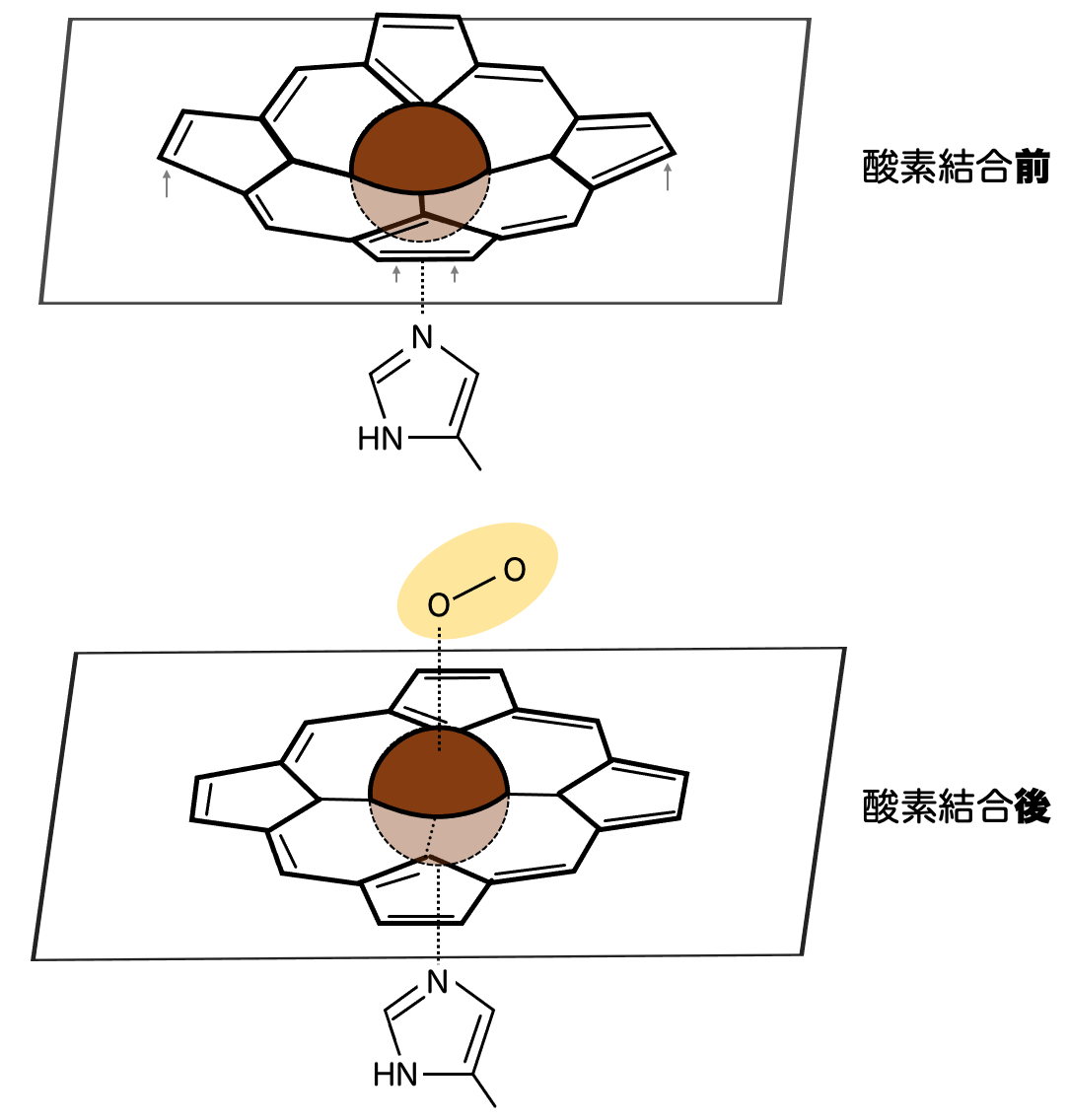
血液が赤いのはヘムが赤色をしているからですが、酸素が結合した状態の血の色(動脈)と酸素が外れた状態の血の色(静脈)は少し違いますよね。これにも実はポルフィリンの構造が関わっています。
ポルフィリンの中心に鉄原子 が置かれることで、ポルフィリンの構造が歪みます。具体的には鉄原子に下から配位しているヒスチジンに引っ張られて、ポルフィリンが上方向にくぼむのでした。これは上で説明した通りです。
さて、ヘムに酸素が結合するというのは、分子的には中心の鉄元素に上から酸素が配位することを意味します。鉄原子には6方向から(正八面体状に)配位することができ、残り1方向から酸素が配位するというわけですね。
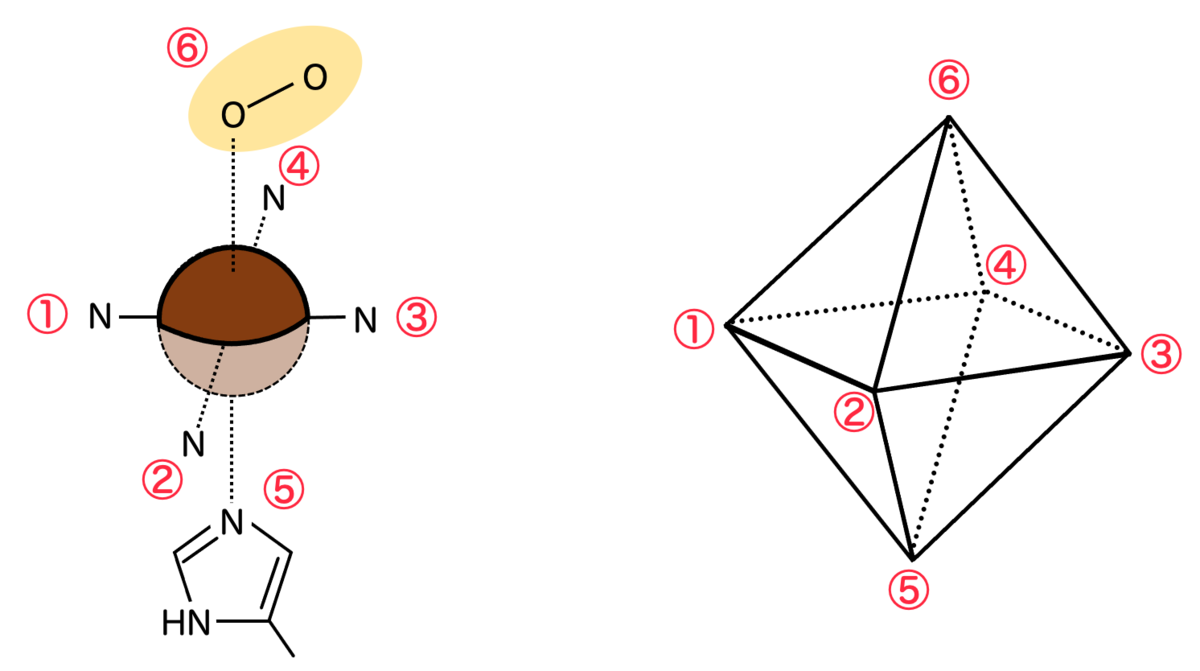
これにより、歪んだポルフィリンの構造が、元の平面構造に戻ります。これにより色がまた変化するというわけです。
6. まとめ
ここまで 「植物の葉の色はなぜ緑色か?」 という問題をひたすら追いかけてきました。いかがだったでしょうか。

長い記事でしたので、議論の流れをまとめてみましょう:

「植物の葉の色が緑色」という事実は知っていても「なぜ緑色なのか」を考えたことはなかなかないと思います。ここまで深く掘り下げられるというのは驚きです。植物の葉の色という、一見マクロな性質を解明するために、最終的には分子軌道にまで至ったというのは、大変興味深いですね。
また、今回の理屈を掘り下げるにあたって、物理・化学・生物・そして農学のすべての知識を総動員したのも注目ポイントです。こんなに多くの分野がつながるのです。色って、なんて深い概念なのだろう。

最後に、この記事を通してみなさんにお伝えしたいのは
ということです。
植物の葉の色というのは、いつもみなさんが観察しているので、大変身近な現象だと思いますが、その仕組みを調べてみるとこんなに深い理屈があったというわけです。量子力学が関係していると看破できた人はそこまで多くなかったのではないでしょうか。
普通だったら「身近な現象」というべきところをあえて「身近だと思っている現象」と言っているのも密かなこだわりです。つまり、身近だと思っているが、その実全然身近ではなかったというわけです。
身近だと思い込んでいる現象に、我々はあまりメスを入れずに漫然と過ごしているわけです。チコちゃんであれば「ボーっと生きてんじゃねーよ!」と言いそうですが、私はそうはいいません。
世の中にはまだまだ知らないことがたくさんあるのです。むしろ、そのことに気づけたことを一緒に喜び、この言葉を贈りたいと思います:
参考文献
今回の記事を書くにあたって、量子化学を一から勉強する必要がありました。
それには以下の2つの教科書が大変役に立ちました。
また、今回扱ったのはクロロフィルという「金属錯体」ですが、その性質については以下の本の一部を参考にしました。この本についてはまだまだ全然理解できていないので、もうしばらく勉強したいと思っています。
最後に、今回の記事を書くための勉強を始めるにあたって、最初に参照したのが キリヤ化学様のQ&A です。これは大変素晴らしいサイトで、「色」についての疑問と答えが、本当に何でも載っているサイトです。
www.kiriya-chem.co.jp
今回は特に以下の記事について、参考にさせていただきました。
このような素晴らしいサイトを運営されているキリヤ化学様に、深く感謝申し上げます。